¡Ayúdame a combatir la leucemia!
Soy Alex, fui diagnosticada con Leucemia Linfoblástica Aguda en marzo de 2024, y estoy recaudando fondos para la investigación contra la leucemia. Tu donación ayudará a financiar investigaciones que buscan salvar vidas.
Dona ahoraContexto:
Los tumores hematológicos, o de las células de la sangre, representan cánceres en gran medida incurables hoy en día. Según datos de la Sociedad Española de Hematología y Hemoterapia, se estima que anualmente en España se detectan alrededor de 30.000 casos anuales. Entre ellos, los más frecuentes son los linfomas (10.000 casos anuales según datos de la Red Española de Registros de Cáncer (REDECAN)), las leucemias (6.000 casos anuales) y los mielomas (3.000 casos anuales). Más información sobre estos tumores aquí.
Estos tumores se pueden controlar en gran parte, pero en muchos casos se producen recaídas de manera bastante impredecible. Esto hace que la supervivencia a estas patologías siga rondando el 50%. Por ello la investigación en este campo es absolutamente fundamental.
.
Descripción del Proyecto:
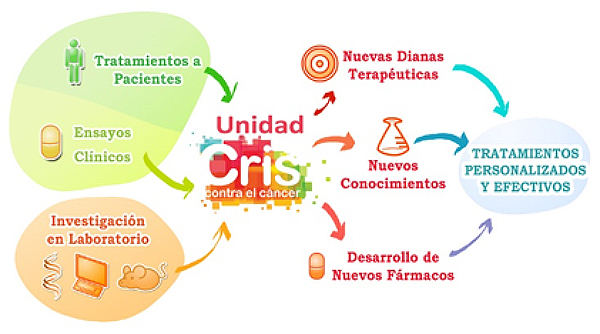
La Unidad CRIS de Tumores Hematológicos consiste en un servicio multidisciplinar que combina la investigación clínica (con pacientes) y la investigación de laboratorio dentro del servicio asistencial de tumores hematológicos del hospital H12O. En el servicio se presta tratamiento a pacientes ingresados, a pacientes asistenciales-ambulatorios, y por otro tienen lugar ensayos clínicos. El funcionamiento de esta unidad permite que los resultados de la investigación lleguen rápidamente a los pacientes a través de ensayos clínicos para tratar estos tumores, que en gran medida son incurables hoy en día.
La Unidad HUNET-CRIS ha sido acreditada por la Comunidad de Madrid para ensayos de Fase I. Actualmente se están llevando a cabo 132 ensayos clínicos, en diversas enfermedades y cánceres hematológicos, principalmente linfomas, leucemias y mieloma múltiple. Desde 2013, cuando se inauguró, más de 660 pacientes han sido tratados en esta unidad, en más de 250 ensayos clínicos. Los innovadores tratamientos utilizados han mostrado ser seguros, ya que el porcentaje de toxicidades derivadas de ellos ha sido muy bajo, y no ha habido ninguna muerte derivada de los tratamientos.
.
.
Avances relevantes desde su inicio:
La Unidad CRIS es un fantástico ejemplo de cómo el apoyo firme a la investigación tiene un impacto directo en la calidad de vida de los pacientes. Desde el inicio de sus actividades en 2013 la Unidad ha desarrollado al menos 15 tratamientos diferentes, basados en las tecnologías más punteras. Algunos ejemplos son los siguientes:
Anticuerpos Monoclonales:
Los anticuerpos monoclonales son uno de los mayores avances de la biotecnología de la historia. Son como terapias teledirigidas, que buscan una diana concreta (generalmente en el tumor o alguna célula de su entorno), se pegan a ella, y producen toda una serie de efectos. Pueden hacer que la célula tumoral muera, que no pueda alimentarse ni crecer y acabe muriendo (por ejemplo, los que se dirigen contra moléculas importantes del tumor, como SLAM7, CD38, BCL2 o CD79), que deje de manipular a su entorno y al sistema inmunitario (como los que se dirigen contra PD-L1), etc. La Unidad ha puesto en práctica varios de estos tratamientos, algunos de los cuales mejoran la supervivencia en más de un 30% de los pacientes, y prolongan el tiempo hasta una recaída hasta un 50%.
Anticuerpos Biespecíficos:
Se trata de dar una vuelta de tuerca a los anticuerpos monoclonales. Son unos anticuerpos modificados por ingeniería genética que se unen a la célula tumoral y a una célula del sistema inmunitario (linfocitos T) simultáneamente. Esto hace que el linfocito T pueda detectar y destruir a la célula tumoral fácilmente. Se administran en inyecciones, y en algunos casos pueden tener un efecto tan potente como el de las células CAR-T. Uno de ellos, el blinatumomab, se ha utilizado para tratar diferentes tipos de leucemias y linfomas.
Inmunomoduladores (o IMIds):
Son unos fármacos que se suelen tomar como pastillas que tienen un efecto doble: por un lado, eliminan a las células de mieloma que van apareciendo, y por otro favorecen una respuesta inmunitaria contra el tumor. Son fáciles de producir y administrar. En la Unidad han trabajado con éxito, por ejemplo, con un fármaco denominado pomalidomida. El hecho de que se puedan utilizar en pastillas supone una enorme ventaja en cuanto a la calidad de vida de los pacientes.
Terapias celulares:
El Dr. Joaquín Martínez se ha especializado en terapias celulares a lo largo de su formación. Con su iniciativa, la unidad ha sido pionera en España en utilizar células CAR-T para el tratamiento de linfomas, leucemias y mielomas (más información aquí). Se trata de linfocitos T a los que se les añade un detector que les ayuda a buscar, identificar y eliminar a las células tumorales (ver ilustración). Según el tipo de tumor pueden llegar a un 80% de eficacia. También son pioneros en el uso de terapias con células Natural Killer (unas células especializadas en detectar y destruir células alteradas o dañadas) en enfermedades de la sangre.
Terapias Dirigidas:
Si en lugar de un tratamiento genérico a los pacientes se les proporciona un tratamiento que ataque específicamente los puntos débiles de su tumor tenemos muchas más opciones de controlar o curar su enfermedad. En esto se basan las terapias dirigidas, unos tratamientos altamente personalizados, que en muchas ocasiones, como el ibrutimib, se pueden administrar como pastillas, y están contribuyendo a la curación de algunas leucemias agudas.
Últimos Avances:
Terapias Celulares:
Entre los objetivos principales de la Unidad consiste en mejorar las terapias celulares actuales. Uno de sus focos son las células Natural Killer, que están cobrando un creciente protagonismo en el tratamiento del cáncer durante los últimos años, como alternativa a los CAR-T. Estas terapias han revolucionado el tratamiento de las enfermedades de la sangre. Sin embargo, en algunos casos producen reacciones hiperinflamatorias y /o neurotóxicas que pueden ser peligrosas para el paciente. Además, las células CAR-T de un donante determinado pueden atacar los tejidos sanos del paciente que recibe la terapia, por eso el tratamiento solo puede realizarse con las células de ese mismo paciente que, aparte de no estar siempre en condiciones óptimas, precisan de un proceso de producción muy costoso y personalizado.
En comparación, las células Natural Killer son mucho más seguras, y no provocan ninguno de estos posibles efectos secundarios. Eso las convierte en una alternativa interesante, pero tienen una serie de problemas: sin manipular, no son tan eficaces como los linfocitos CAR-T, los tumores también pueden adaptarse a ellas, y cuando se introducen en el paciente no suelen durar mucho en circulación. Para abordar estos problemas, y convertir a las células Natural Killer en terapias sólidas, los laboratorios de la Unidad CRIS, con el Dr. Antonio Valeri liderando este proyecto, han desarrollado una ambiciosa estrategia de investigación.
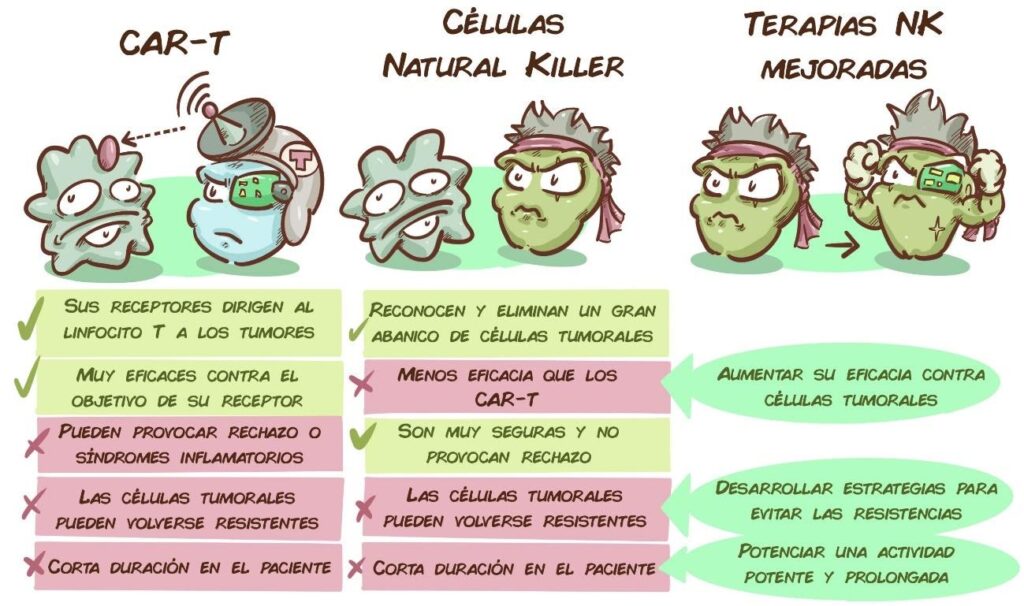
Para potenciar su eficacia, se está trabajando en desarrollar terapias con células NK modificadas con un receptor adicional, es decir, células CAR-NK. Entre los receptores/radares que se les añaden, encontraríamos NKG2D (que reconoce células alteradas, infectadas y tumorales) o un receptor que identifica BCMA (una molécula que aparece frecuentemente en las células de mieloma). Estos modelos están funcionando in vitro muy bien contra células de leucemias y mieloma.
Aun así, la introducción de estos receptores CAR en células NK es tradicionalmente muy complicada, y es difícil conseguir suficientes células modificadas con estos receptores como para ser una terapia eficaz. Para superar este obstáculo el equipo de la Unidad ha desarrollado un método que permite que las NK dejen de ser refractarias a la expresión de estos receptores añadidos (es decir, que terminen por presentarlos en su superficie).
Para combatir las resistencias de las células tumorales, han establecido una novedosa estrategia. A medida que los mielomas avanzan y el sistema inmunitario intenta combatirlo, en las células tumorales aumenta la expresión (la aparición en su superficie) de una molécula (HLAE) que apaga la actividad de las células Natural Killer. Esto hace que las células tumorales puedan crecer tranquilamente, sin preocuparse de las células NK. No obstante, el laboratorio ha podido comprobar que si se bloquea su receptor natural NKG2A, mediante anticuerpos neutralizantes, las células NK CAR recuperan su actividad. Este hallazgo podría ser de enorme importancia para que las terapias con células NK funcionen mejor y las células tumorales no puedan adaptarse.
De hecho, actualmente trabajan en unas células NK modificadas para combatir el mieloma múltiple. Por un lado se les han eliminado mediante la tecnología CRISPR (que permite modificaciones del ADN de manera rápida y eficaz) ciertos frenos moleculares como el mencionado HLAE. Además, se les ha incluido un CAR, un detector/radar, con la molécula NKG2D. Los experimentos in vitro (con modelos celulares) han mostrado una muy buena eficacia contra las células de mieloma. Ahora el equipo está poniendo a punto experimentos en modelos animales. Esto será todo un reto, porque conseguir suficientes células NK modificadas para poder hacer experimentos in vivo (que requieren muchísimas) es sumamente complicado. No obstante, el equipo trabaja en soluciones para obtener células suficientes.
Para aumentar la duración de las células NK en el paciente, el equipo de la Unidad CRIS ha puesto a punto un método propio de cultivo que potencia mucho las células NK: duran mucho más, y a diferencia de las células NK normales, son mucho más eficientes la segunda vez que se enfrentan a una misma amenaza. Esta última característica es la que da nombre a este tipo de células NK, células NK de memoria inducida, y puede ser clave en la lucha contra las recaídas.
Producción de CAR-T EN los pacientes:
La Unidad CRIS está buscando, también, una solución a uno de los mayores problemas que suponen las terapias CAR (tanto con linfocitos T como con células NK): Estas terapias requieren extraer células del paciente, modificarlas en unas instalaciones especiales durante semanas y luego volver a introducirlas en el paciente. Esto requiere instalaciones complejas y costosas, un personal sumamente entrenado, y unos materiales muy exclusivos y caros. Si el proceso se simplificase, sería sumamente beneficioso.
Con esto en mente, el equipo está trabajando en un innovador procedimiento que consiga producir las células CAR dentro del paciente: Las instrucciones para producir el receptor CAR irían empaquetadas dentro de virus modificados e inofensivos, que simplemente llevarían estas instrucciones a los linfocitos o a las células NK. Este proceso podría revolucionar el tratamiento de las enfermedades de la sangre, ya que además de simplificar y abaratar el proceso, permitiría reaccionar rápidamente a medida que la enfermedad progresa e ir inyectando instrucciones con diferentes CAR. En estos momentos el equipo está trabajando en unas partículas virales que no sólo llevan instrucciones a células NK, sino que además las estimulan y activan.
Plataformas animales para estudiar el Mieloma Múltiple:
En cualquier caso, una vez se desarrolla una terapia, antes de que llegue a los pacientes debe probarse en modelos animales. Es importante contar con modelos que reproduzcan la enfermedad humana lo más fielmente posible, para que los tratamientos que se prueben den resultados extrapolables a la realidad. Ahora bien, hasta hace poco no había buenos modelos del mieloma múltiple que permitieran estudiar esta enfermedad correctamente. Para solucionar esto, la Unidad ha desarrollado un modelo predictivo de ratón absolutamente pionero. En él se desarrolla el mieloma múltiple humano en el entorno inmunológico de un sistema inmunológico derivado de los propios pacientes. Al tratarse de la enfermedad humana, no el equivalente animal, este modelo es ideal para evaluar los tratamientos que un día llegarán a los pacientes.
Actualmente, este modelo de mieloma múltiple está en proceso de patentarse.
Papel de la Microbiota en la respuesta a terapias CAR-T:
Otra línea muy novedosa que se está llevando a cabo para mejorar la eficacia de las terapias celulares, incluidas las células CAR-T tiene que ver con la microbiota intestinal. Durante los últimos años la microbiota ha revelado tener un papel sorprendentemente relevante en la respuesta inmunitaria, incluída la respuesta contra los tumores. Estudios recientes han demostrado que los pacientes que poseen en su intestino determinadas poblaciones de microorganismos responden mejor a determinadas terapias, y que el trasplante de microbiota puede hacer que pacientes con tumores resistentes se vuelvan sensibles. La Unidad quiere dar una vuelta de tuerca a este concepto y verificar si hay microorganismos asociados a la respuesta de los pacientes a las terapias CAR-T, si el trasplante de microbiota (o el tratamiento con algunas de las moléculas que producen estos microorganismos) podría ser una opción para pacientes que no responden a CAR-T.
Tratamientos revolucionarios contra el mieloma múltiple:
Por otro lado, la Unidad ha participado en un trabajo extraordinario publicado en el New England Journal of Medicine, una de las 3 revistas científicas más importantes del mundo. Consiste en un ensayo clínico internacional en el que han tomado parte 165 pacientes con mieloma avanzado. Estos pacientes han un anticuerpo creado por ingeniería genética denominado teclistamab. Este tipo de tecnología es similar a la que ya se usa en la Unidad CRIS de Inmuno-Oncología por un lado se une a una molécula del mieloma (BCMA) y por el otro a los linfocitos T. De esta manera los linfocitos encuentran y destruyen a las células tumorales fácilmente. Lo relevante del ensayo es que más del 70% de los pacientes ha mejorado, y cerca de un 30% de los pacientes tuvo una respuesta completa, es decir, su enfermedad se volvió indetectable. Además, a diferencia de las terapias CAR-T, esta terapia no requiere gran infraestructura y se administra por vía subcutánea, muchísimo más sencillo. Estos grandes resultados hacen pensar que esta terapia probablemente se autorice en la práctica clínica en muy poco tiempo.
Nuevas dianas en el tratamiento del Mieloma Múltiple y otras enfermedades Hematológicas:
El Dr. Miguel Gallardo, que forma parte del equipo de la Unidad, ha constatado que una proteína llamada HNRNPK podría jugar un papel importante en el desarrollo de enfermedades de la sangre como el mieloma. Se trata de una promiscua proteína que en condiciones normales ayuda a la célula a superar periodos de estrés. Sin embargo, si está fuera de control podría contribuir a que las células sanas tengan defectos en su funcionamiento y contribuya al proceso tumoral. Esta proteína tiene, por tanto un gran interés y el equipo está analizando en profundidad su funcionamiento y como poder aplicar este conocimiento en la práctica clínica.
Para analizar su papel en enfermedades de la sangre, desarrollaron un ratón con niveles muy altos de esta proteína para comprender mejor el mecanismo. De manera inesperada observaron que los animales envejecían a toda velocidad. Al parecer, muchas células, especialmente las células madre de la sangre, envejecían rápidamente en un proceso que se denomina senescencia. El mecanismo es complejo, pero esencialmente lo que pasa es que cuando HNRNPK se encuentra elevado, la célula interpreta que hay altos niveles de estrés e intenta paralizar toda su maquinaria biológica. En circunstancias normales, estas células terminarían muriendo, sin embargo en este caso no lo hacen, y al quedarse en una especie de letargo, apenas responden a estímulos externos lo que las hace muy difíciles de matar.
La relación con el cáncer es la siguiente: Los pacientes que tienen altos niveles de HNRNPK no responden bien a los tratamientos. Parece ser que es porque las células con mucho HNRNPK detienen en seco su ciclo vital, se atrincheran e ignoran las señales externas como son los tratamientos. Esto significa que si conseguimos rejuvenecer a estas células (y existen compuestos que lo hacen) podríamos devolver su sensibilidad a los tratamientos en pacientes en recaída, algo que supondría un avance fantástico en enfermedades como la leucemia mieloide aguda o el mieloma múltiple. Parte de este trabajo, que está en proceso de publicarse, fue premiado en el congreso de la European Hematology Association con el Young EHA PhD Research Student Award, otorgado al doctorando de Miguel Gallardo, Pedro Aguilar Garrido.