La investigación sobre el cáncer de mama ha transformado por completo la manera en que entendemos, diagnosticamos y tratamos esta enfermedad.
Desde las primeras descripciones en el Antiguo Egipto hasta la actual era de la medicina de precisión, los avances científicos han permitido mejorar la supervivencia y la calidad de vida de millones de mujeres en todo el mundo.
Hoy, la ciencia continúa abriendo nuevas fronteras en la detección temprana, la personalización de terapias y la prevención de recaídas, consolidando al cáncer de mama como uno de los campos más dinámicos y esperanzadores de la oncología moderna.
Índice de contenidos:
De los papiros del Antiguo Egipto a la revolución molecular
El cáncer de mama es, hoy por hoy, el tipo de cáncer más diagnosticado del mundo y, aunque no es el que más muertes causa en términos absolutos, sí es el quinto en mortalidad global. Esta realidad lo convierte en uno de los grandes retos de la medicina actual. Pero lo cierto es que este tumor no es precisamente nuevo: su historia está profundamente entrelazada con la evolución del pensamiento médico y científico. Y, paradójicamente, casi todo lo que sabemos (y casi todos los tratamientos eficaces) tienen menos de un siglo de historia
Ya en el antiguo Egipto, el médico-arquitecto Imhotep describió en el papiro Edwin Smith (2500–3000 a.C.) lo que probablemente eran tumores mamarios, estableciendo incluso que ciertos bultos fríos, extendidos y abultados no tenían cura. Más tarde, Hipócrates (460–377 a.C.) propuso que el cáncer se debía a un exceso de bilis negra, según su famosa teoría de los cuatro humores, una idea que compartió Galeno en el siglo II d.C., recomendando sangrías abundantes como tratamiento para esta enfermedad.
Durante siglos, estos enfoques dominaron la medicina, y no fue hasta el Renacimiento, con el auge de la anatomía y la cirugía (ya por fin separada de la barbería), cuando comenzaron las primeras mastectomías, aunque aún sin anestesia ni antibióticos.
El gran salto llegó en el siglo XIX, con la introducción de la anestesia, la asepsia y, sobre todo, con mejores técnicas quirúrgicas. En 1894, el cirujano estadounidense William Halsted desarrolló la primera mastectomía radical, una cirugía extensa que se convirtió en el estándar durante más de 70 años. Aunque fue un avance, también supuso intervenciones muy agresivas, que no siempre eran necesarias.
A finales del siglo XIX, Wilhelm Röntgen descubrió los rayos X y Marie Curie el radio, sentando las bases de la radioterapia. Poco después, Emile Grubbe, fue uno de los primeros médicos en usar radioterapia como método curativo para pacientes con cáncer. En los años 50, el grupo estadounidense NSABP (National Surgical Adjuvant Breast and Bowel Project) demostró que la combinación de cirugía conservadora y radioterapia podía ser tan eficaz como la mastectomía radical, revolucionando el tratamiento.
En paralelo, la quimioterapia y la hormonoterapia fueron dando pasos clave. En los años 70 se empezó a comprender el papel de las hormonas en el desarrollo del tumor, lo que llevó a la aprobación en 1978 del tamoxifeno, un fármaco que bloquea los receptores de estrógeno.
Esto es importante porque los estrógenos constituyen un alimento fundamental para el desarrollo de un subtipo de tumores mamarios, los denominados hormonales, que son los más frecuentes. Fue el inicio de las terapias hormonales, aún fundamentales hoy día.
Un hito clave en la investigación en cáncer de mama llegó en los años 80. En 1987, el oncólogo Dennis Slamon identificó que una parte de las pacientes, aproximadamente una de cada cinco, tenía una sobreproducción de una proteína, llamada HER2, y esto se asociaba a peor pronóstico.
Tras años de investigación, en 1998 se aprobó trastuzumab (Herceptin®), el primer anticuerpo monoclonal contra HER2, lo que marcaba el inicio de las terapias biológicas. El trastuzumab cambió de manera drástica el pronóstico de los tumores HER2 positivos, incrementando de manera muy importante la supervivencia de las pacientes, sobre todo cuando se asocia a quimioterapia.
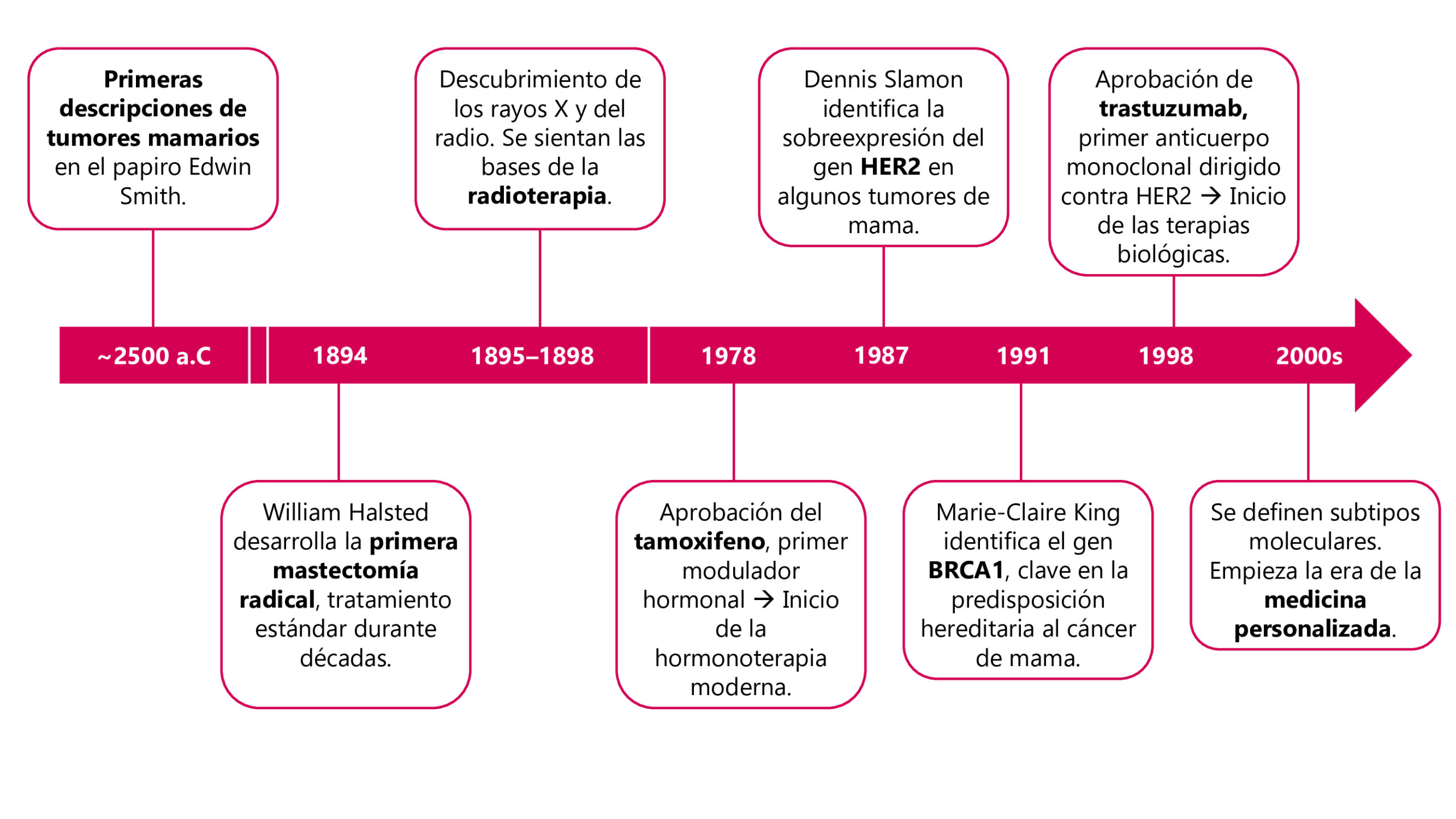
Casi al mismo tiempo, en 1991, la genetista Marie-Claire King descubrió el gen BRCA1, seguido por BRCA2, responsables de la predisposición hereditaria a cáncer de mama y ovario. Este descubrimiento no solo permitió estrategias preventivas en mujeres de alto riesgo, sino también abrió la puerta a tratamientos personalizados para pacientes con estas alteraciones genéticas.
Ya en el siglo XXI, la revolución en el campo del cáncer de mama ha venido de la mano de estudios moleculares. Se catalogó el cáncer de mama en varios subtipos (como luminal A, luminal B, HER2+ y triple negativo) según las moléculas presentes en estos tumores, lo que ha permitido personalizar los tratamientos.
La medicina de precisión ha incorporado pruebas genéticas y anatomopatológicas para guiar terapias, técnicas quirúrgicas y radioterapias menos agresivas y más eficaces, así como nuevas estrategias terapéuticas.
Principales avances en las distintas áreas del cáncer de mama
Cada uno de los pilares del tratamiento del cáncer de mama (cirugía, radioterapia, terapia sistémica y medidas de apoyo) ha mejorado notablemente con el tiempo gracias a la investigación:
Cirugía más conservadora y reconstructiva
Hoy en día, siempre que es posible, se intenta preservar la mama extirpando solo el tumor (cirugía conservadora o tumorectomía) sin perder eficacia curativa.
La cirugía de la axila también se ha vuelto menos invasiva: gracias a la biopsia del ganglio centinela, muchas pacientes evitan una disección completa de los ganglios linfáticos axilares si no hay indicios de extensión de la enfermedad, lo que reduce significativamente el riesgo de efectos secundarios como el linfedema (hinchazón del brazo por acumulación de líquido linfático).
Debemos tener en cuenta que los vasos linfáticos actúan como una especie de alcantarilla que recoge fluido (linfa) que se va acumulando en los tejidos y sistemas orgánicos.
Si eliminamos la función linfática, los tejidos a los que sirven, se inundan de la linfa. Como si se atascase una tubería. Y eso causa el edema por causa linfática (linfedema). Es un síntoma molesto, que conviene evitar en la medida de lo posible.
Además, se han desarrollado técnicas microquirúrgicas novedosas para reducir este riesgo. Por ejemplo, algunos centros realizan mapeo linfático inverso (identificar y preservar los vasos linfáticos del brazo durante la cirugía) o bypass linfovenosos (reconectar vasos linfáticos a venas) cuando se extraen ganglios, lo que ayuda a mantener el drenaje linfático normal.
Gracias a estas mejoras, la cirugía actual busca no solo curar, sino también mantener la mejor calidad de vida posible para las supervivientes.
Radioterapia optimizada
La radioterapia ha sido durante décadas un complemento esencial de la cirugía mamaria, especialmente tras cirugías conservadoras, con el fin de evitar la reaparición de la enfermedad.
Los avances tecnológicos han permitido tratamientos más precisos y cómodos para las pacientes, evitando también efectos secundarios ligados al tratamiento. Hoy se emplean técnicas de planificación 3D, IMRT (radioterapia de intensidad modulada) y radioterapia guiada por imagen, que concentran la dosis en el tejido mamario afectado protegiendo al máximo los órganos sanos.
Además, ciertos estudios han demostrado que cursos hipofraccionados (dosis más alta por sesión en menos sesiones) logran igual control del cáncer con menos visitas al hospital. Incluso se ha desarrollado la radioterapia intraoperatoria para algunos casos, administrando una dosis única de radiación durante la cirugía directamente en el lecho tumoral.
La radioterapia postoperatoria reduce de forma significativa las recurrencias y la mortalidad por cáncer de mama, por lo que el desafío ha sido hacerla cada vez más segura y accesible.
Actualmente, la radioterapia forma parte del manejo estándar en muchos escenarios (cánceres localizados, tras cirugías conservadoras, o para aliviar metástasis), con protocolos que se han ido transformando y mejorando, hasta lograr tratamientos más cortos y eficaces que los usados décadas atrás.
Quimioterapia y hormonoterapia (terapias sistémicas tradicionales)
La quimioterapia ha salvado innumerables vidas al atacar células tumorales que pudieran quedar en el organismo después de la cirugía, y así evitar posibles recaídas.
Desde los años 70, sucesivos ensayos clínicos mostraron que combinar varios fármacos quimioterápicos (poliquimioterapia) como adyuvantes (es decir, tras la cirugía) reduce las recaídas y mejora la supervivencia a largo plazo. Por su parte, la terapia hormonal (endocrina) transformó el panorama para los tumores con receptores de estrógeno o progesterona (que representan alrededor de 2 de cada 3 casos).
Un avance reciente en este campo son los llamados SERDs orales (degradadores selectivos del receptor de estrógeno), que eliminan la capacidad del tumor de crecer con los estrógenos.
Por ejemplo, el elacestrant (un SERD administrado por vía oral) fue aprobado en 2023 y ha mostrado ser muy eficaz para pacientes con cáncer de mama metastásico con receptor de estrógenos (ER+) que presentan alteraciones en el gen ESR1, que es el gen que precisamente se encarga de hacer al receptor de estrógenos.
Las alteraciones del gen ESR1 suelen conferir resistencia a la hormonoterapia convencional, y por ello es necesario desarrollar nuevas estrategias como es el caso de los SERDs.
Gracias a la disponibilidad de múltiples terapias hormonales, hoy es posible controlar por largos periodos los cánceres de mama hormonales con relativa baja toxicidad.
Además, se ha logrado refinar el uso de la quimioterapia con pruebas de expresión génica que identifican qué pacientes con cáncer temprano realmente se benefician de añadir quimioterapia a la hormonoterapia, evitando tratamientos innecesarios en aquellas de bajo riesgo.
Otra estrategia que funciona en el tratamiento de los tumores ER+ se basa en una nueva generación de fármacos que se llaman inhibidores de quinasas de ciclinas (CDK). Estos fármacos actúan sobre ciertas proteínas que son indispensables para que la célula tumoral se duplique. Inhibiendo a esas proteínas se consigue afectar el crecimiento tumoral.
En resumen, el tratamiento sistémico se ha vuelto más personalizado y adaptado a cada paciente y tumor.
Terapias dirigidas y nuevas estrategias moleculares
La última década del siglo XX vio el nacimiento de las terapias dirigidas, que atacan específicamente alteraciones moleculares del cáncer de mama.
El ejemplo clásico es trastuzumab (Herceptin®), anticuerpo que se dirige contra la proteína HER2: su introducción en 1998 mejoró radicalmente la evolución de los tumores HER2 positivos.
A partir de ese éxito, se desarrolló toda una gama de fármacos dirigidos: otros anticuerpos contra HER2 (p. ej. pertuzumab) potencian aún más las respuestas cuando se combinan con trastuzumab; también se crearon terapias antiangiogénicas (como bevacizumab, que ataca los vasos sanguíneos del tumor).
Un campo especialmente revolucionario ha sido el de los conjugados anticuerpo-fármaco (ADCs), medicamentos que constan de un anticuerpo dirigido al tumor unido a un fármaco quimioterápico potente que se libera directamente dentro de la célula cancerosa.
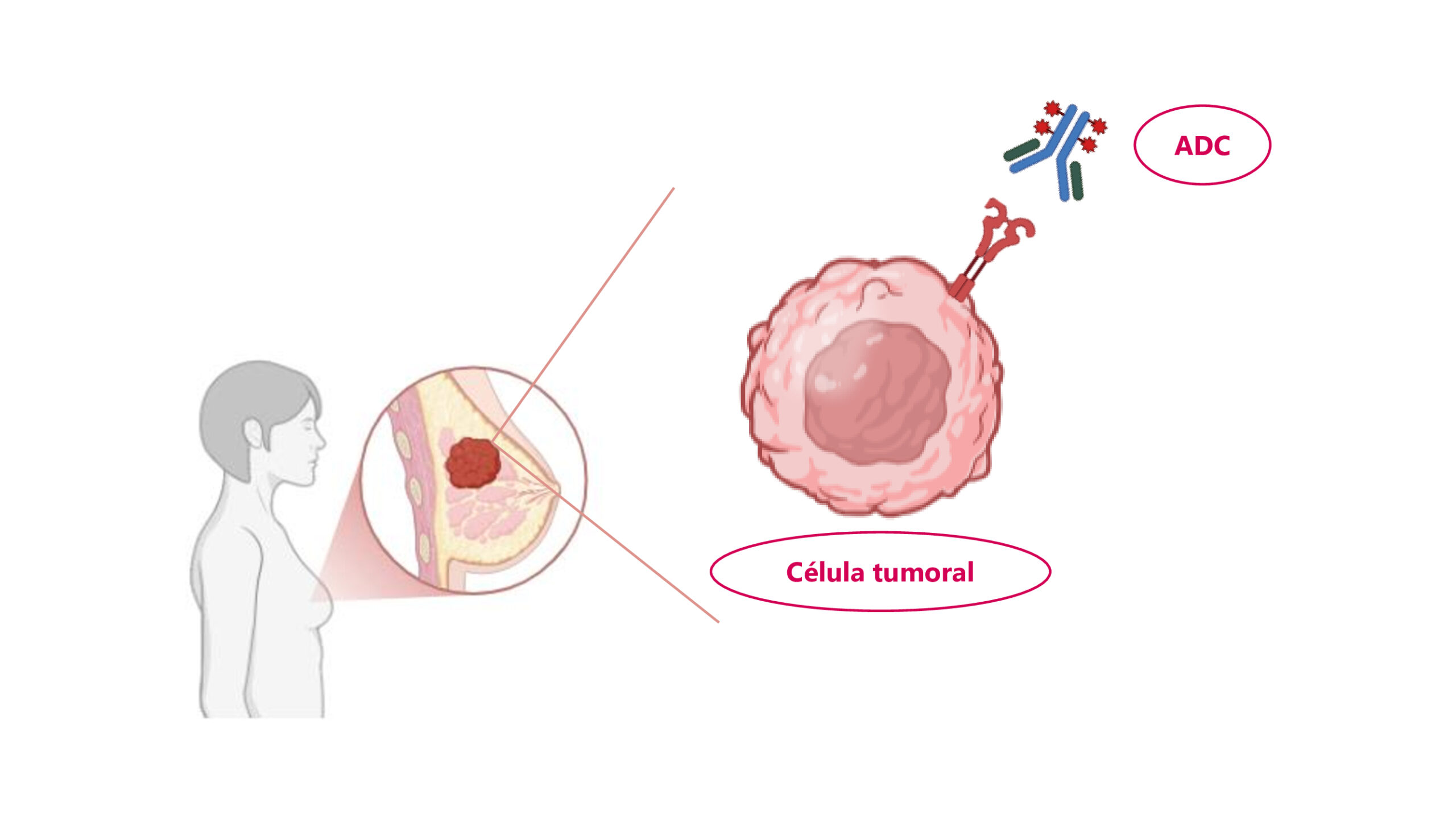
Un ADC destacado es trastuzumab deruxtecán (Enhertu), dirigido a HER2: inicialmente aprobado para cáncer de mama HER2+ avanzado, en 2022 demostró beneficio incluso en pacientes con expresión baja de HER2, extendiendo su uso a un nuevo grupo de pacientes.
Otro ADC novedoso es sacituzumab govitecán (Trodelvy®), dirigido a una proteína llamada TROP2, que ha mostrado prolongar el control de la enfermedad en cáncer de mama metastásico (incluyendo el difícil subtipo triple negativo) comparado con quimioterapia estándar.
Este fármaco llegó en 2021, y ahora hay otro parecido, que también ataca a TROP2, llamado datopotomab deruxtecan. De hecho, este fármaco acaba de ser aprobado en 2025 por la FDA para ciertos tipos de cáncer de mama metastásico y está en proceso de aprobación por parte de la EMA, en Europa, y del Sistema Nacional de Salud en España.
En tumores relacionados con mutaciones genéticas heredadas, otro avance importante fueron los inhibidores de PARP (como olaparib), dirigidos a tumores con mutaciones en los genes BRCA1/2.
Asimismo, para los tumores con receptores hormonales en enfermedad avanzada, la introducción de los inhibidores de CDK4/6 (palbociclib, ribociclib, abemaciclib), que ya hemos mencionado, supuso un gran hito en cuanto a disponibilidad de tratamientos para estas pacientes. Combinando varios de estos avances, se están obteniendo resultados sin precedentes.
Inmunoterapia y tratamientos emergentes
Más recientemente, la inmunoterapia se ha sumado al arsenal contra el cáncer de mama. Durante mucho tiempo se pensó que el cáncer de mama era poco visible para el sistema inmunitario, pero estudios de la última década cambiaron esa percepción.
Los fármacos llamados inhibidores de puntos de control inmunitario, que reactivan los linfocitos T del paciente para que ataquen al tumor, han mostrado eficacia especialmente en el cáncer de mama triple negativo (un subtipo agresivo que carece de receptores hormonales y que tampoco contiene HER2). El anticuerpo pembrolizumab (que bloquea un receptor de las células inmunitarias) demostró mejorar la supervivencia de determinadas pacientes con cáncer de mama triple negativo metastásico, así como resultados positivos también en fases más tempranas de esta enfermedad.
Estos y otros hitos marcan la entrada de la inmunoterapia en el tratamiento de este tipo de cáncer, algo impensable hace años.
Actualmente se investiga cómo extender estos beneficios a más pacientes. Más allá de los anticuerpos, hay estrategias experimentales muy innovadoras en ensayo.
Estrategias experimentales actuales
Una es la utilización de terapias celulares: muchos científicos están explorando la posibilidad de extraer linfocitos del propio tumor de la paciente (llamados TILs), expandirlos y activarlos en el laboratorio, y después reinyectarlos para que ataquen al cáncer – un enfoque que ha dado resultados prometedores en otros tumores sólidos.
La idea es que estos linfocitos del propio paciente son capaces de atacar al tumor, pero son pocos. Por tanto lo que se pretende es crear un ejército mucho más numeroso de linfocitos T antitumor, y además estimularlos en el laboratorio para que al ser reinyectados estén “en mejor forma”. De esta manera, se pretende incrementar la respuesta antitumoral propia, derivada de nuestras células inmunitarias.
Otra aproximación es la terapia con células CAR-T, en la cual se modifican genéticamente linfocitos T del paciente para que reconozcan una diana específica en las células tumorales.
Si bien la terapia con células CAR-T ha revolucionado algunos cánceres de la sangre, en cáncer de mama aún está en fases iniciales.
Asimismo, se están desarrollando vacunas terapéuticas contra el cáncer de mama con la intención de entrenar al sistema inmunitario para prevenir recaídas; varias de estas vacunas se encuentran en ensayos clínicos tempranos.
En resumen, la inmunooncología aplicada al cáncer de mama es un campo muy activo. Los estudios recientes son muy positivos al mostrar que, afrontando de manera conjunta diferentes vías de escape del tumor, se puede lograr aumentar la supervivencia y mejorar la calidad de vida incluso en enfermedad metastásica.
Principales avances de los últimos años
Tratamientos combinados
La investigación reciente ha dado lugar a nuevos tratamientos combinados. En 2025, el ensayo INAVO120 demostró que combinar inavolisib (inhibidor de una proteína llamada PI3K), palbociclib (inhibidor de CDK4/6) y fulvestrant (antihormonal) mejora significativamente la supervivencia en pacientes con cáncer metastásico HR+ con determinadas alteraciones en el ADN.
También se aprobó el uso de capivasertib, un inhibidor de AKT, para casos resistentes a hormonoterapia.
Aplicación de la Inteligencia Artificial
En el campo del diagnóstico, ensayos como TMIST están evaluando si la mamografía 3D supera a la convencional. Se están explorando también herramientas de inteligencia artificial para mejorar la detección precoz, así como cribados personalizados en función del riesgo individual (estudio WISDOM).
En casos como el carcinoma ductal in situ, ensayos recientes han demostrado que la vigilancia activa en lugar de tratamientos intensivos puede ser segura en algunas pacientes concretas cuidadosamente seleccionadas según sus características.
Un hallazgo interesante del National Cancer Institute (NCI) de Estados Unidos en 2025 ha sido que, antes incluso de que se forme un tumor de mama, el tejido de soporte (el andamiaje que rodea a las células epiteliales) puede mostrar señales de alarma. Ciertas alteraciones en ese tejido de soporte mamario predicen que, si llegase a aparecer un cáncer, éste tenderá a comportarse de forma más agresiva.
En otras palabras, gracias a esas señales de alarma tempranas en el tejido de sostén, podríamos anticiparnos al tumor: detectar quién corre un riesgo mayor de desarrollar un cáncer agresivo y, por tanto, actuar antes, por ejemplo, con chequeos más frecuentes o estrategias preventivas, para intentar frenarlo antes de que aparezca.
Biopsia líquida
Por último, una de las áreas más vanguardistas es la biopsia líquida y la monitorización molecular. Hoy es posible detectar fragmentos de ADN tumoral (llamado ADN tumoral libre) en la sangre de pacientes con cáncer de mama, lo que permite hacerse una idea del estado del tumor sin tener que realizar biopsias quirúrgicas. Solo mediante un análisis de sangre.
Esto abre la posibilidad de seguir en tiempo real la respuesta a tratamiento e incluso identificar recurrencias o enfermedad residual mínima mucho antes de que sean visibles por métodos de imagen.
Ensayos como el estudio c-TRAK TN en el Reino Unido están evaluando si, detectando ADN tumoral tras tratamiento curativo en pacientes con alto riesgo (p. ej. triple negativo), se puede intervenir precozmente (con inmunoterapia) para mejorar resultados.
Aunque esta estrategia aún no es estándar, representa el siguiente nivel de personalización: tratamientos guiados no solo por características iniciales del tumor, sino por su huella molecular residual en el paciente.
España como referente en investigación y perspectivas futuras
España se ha consolidado como un país líder en investigación clínica, ocupando el primer puesto en Europa y el segundo en el mundo en volumen de estudios en cáncer, muchos de ellos en cáncer de mama, que han permitido que miles de pacientes accedan a tratamientos innovadores.
La colaboración internacional, con entidades como la EORTC, y la financiación europea han favorecido grandes ensayos en áreas como metástasis, calidad de vida y genética poblacional. La velocidad de los avances, junto con la aplicación de herramientas como la inteligencia artificial y la genómica, augura una nueva era en la lucha contra esta enfermedad.
Mirando hacia el futuro, las perspectivas son optimistas. Si bien el cáncer de mama sigue siendo un problema de salud importante, los avances científicos han logrado que una mayoría de pacientes puedan superar la enfermedad y las líneas de investigación en curso prometen seguir mejorando estos resultados.
Un objetivo importante es vencer la resistencia a los tratamientos – por ejemplo, combinando terapias de manera secuencial o simultánea para que el cáncer no encuentre vías de escape. Asimismo, la atención se está centrando en la calidad de vida y la personalización de tratamientos.
En este sentido, desde CRIS contra el Cáncer impulsamos diversos proyectos en cáncer de mama para dar respuesta a los principales retos de la actualidad:
- Evitar las metástasis [Proyecto CRIS de Metástasis en Cáncer de Mama]
- Frenar las resistencias a tratamientos [Proyecto CRIS de Resistencias en Cáncer de Mama]
- Personalizar las terapias [Unidad CRIS de Nuevas Terapias Experimentales], [Proyecto CRIS de Inmunoterapia en Cáncer de Mama]
- Mejorar las clasificaciones moleculares y adaptar los tratamientos [Proyecto CRIS de Cáncer de Mama Hormonopositivo]
- Adelantarnos a nuevas vías de escape tumoral y desarrollar fármacos innovadores [Proyecto CRIS de Cáncer de Mama]
- Medicina de precisión [Gemelas Digitales]
En conclusión, el panorama de la investigación sobre el cáncer de mama refleja enormes logros históricos y un continuo flujo de innovaciones. Lo que antes era una enfermedad prácticamente incurable, hoy es tratable con altas tasas de éxito, gracias a la ciencia.
Cada avance – desde la cirugía conservadora hasta los fármacos dirigidos – se ha traducido en vidas salvadas y en supervivientes viviendo más y mejor. En especial, las últimas tres décadas han revolucionado completamente la oncología del cáncer de mama, y la velocidad de los avances parece ir en aumento.
Aun así, el compromiso de investigadores, médicos, pacientes y sociedades de todo el mundo sigue siendo vital para responder a las preguntas que quedan. Y sólo hay una respuesta: La investigación.
Bibliografía
Breast Cancer Research Foundation. (2023). Breast cancer statistics and resources. BCRF. https://www.bcrf.org/breast-cancer-statistics-and-resources/
Cancer Research UK. (2023). Past research into breast cancer. Cancer Research UK. https://www.cancerresearchuk.org/our-research/our-research-by-cancer-type/our-research-into-breast-cancer/past-breast-cancer-research
Cancer Research UK. (2023, September 1). One million lives saved. Cancer Research UK News. https://news.cancerresearchuk.org/2023/09/01/one-million-lives-saved/
Fisher, B., Bauer, M., Margolese, R., Poisson, R., Pilch, Y., Redmond, C., Fisher, E., Wolmark, N., Deutsch, M., Montague, E., Saffer, E., Wickerham, L., Lerner, H., Glass, A., & Shibata, H. (1985). Five-year results of a randomized clinical trial comparing total mastectomy and segmental mastectomy with or without radiation in the treatment of breast cancer. The New England Journal of Medicine, 312(11), 665–673. https://doi.org/10.1056/NEJM198503143121101
International Agency for Research on Cancer (IARC). (2022). Breast cancer. World Health Organization. https://www.who.int/news-room/fact-sheets/detail/breast-cancer
National Cancer Institute. (2019). Breast cancer fact sheet. National Institutes of Health. https://pmc.ncbi.nlm.nih.gov/articles/PMC6462164/
National Cancer Institute. (2021). Milestones in cancer research and discovery. U.S. Department of Health and Human Services. https://www.cancer.gov/research/progress/250-years-milestones
Mayo Clinic. (2024, July 17). Treating breast cancer through surgery. Mayo Clinic Cancer Blog. https://cancerblog.mayoclinic.org/2024/07/17/treating-breast-cancer-through-surgery/
Mayo Clinic. (2023). Breast cancer surgery – care at Mayo Clinic. Mayo Clinic. https://www.mayoclinic.org/tests-procedures/breast-cancer-surgery/care-at-mayo-clinic/pcc-20385257
Sociedad Española de Oncología Médica (SEOM). (2021). Informe de evaluación de valor de trastuzumab deruxtecán en cáncer de mama HER2 positivo avanzado. SEOM. https://seom.org/seomcms/images/stories/Informes_SEOM/IEV_SEOM_trastuzumab_deruxtecan_mama_her2_positivo.pdf
Sociedad Española de Oncología Médica (SEOM). (2021). Informe de evaluación de valor de sacituzumab govitecán en cáncer de mama triple negativo metastásico. SEOM. https://seom.org/seomcms/images/stories/Informes_SEOM/IEV_sacituzumab_govitecan_mama_triple_negativo_metastasico.pdf
Sociedad Española de Oncología Médica (SEOM). (2019). Informe de posicionamiento terapéutico de palbociclib en cáncer de mama metastásico. SEOM. https://seom.org/seomcms/images/stories/Informes_SEOM/IPT_Palbociclib.pdf
Sociedad Española de Oncología Médica (SEOM). (2018). Notas de prensa y becas de investigación en cáncer de mama. SEOM. https://seom.org/prensa/noticias?Itemid=159&id=24&lang=es&limit=15&limitstart=15&month=8&option=com_content&start=15&view=category&year=2018














