Contexto:
Dentro de los tumores infantiles, los tumores del sistema nervioso central son los segundos más frecuentes, por detrás de las leucemias agudas. Sin embargo, siguen siendo la primera causa de muerte por cáncer infantil, por su heterogeneidad y su dificultad para tratarlos de manera eficaz.
Uno de los tumores cerebrales infantiles más agresivos es el Glioma Pontino Intrínseco Difuso (DIPG, por sus siglas en inglés). Afecta casi exclusivamente a niños entre 4 y 11 años, y los niños que lo padecen tienen una esperanza de vida muy corta, de aproximadamente 1 año. Uno de sus mayores problemas es que se desarrollan en una zona del cerebro donde se contienen funciones corporales esenciales para la vida, el puente cerebral. Esa zona del cerebro regula la respiración, el movimiento ocular o incluso el latido del corazón. Por lo tanto, las intervenciones quirúrgicas en esta zona son demasiado peligrosas y no se pueden hacer.
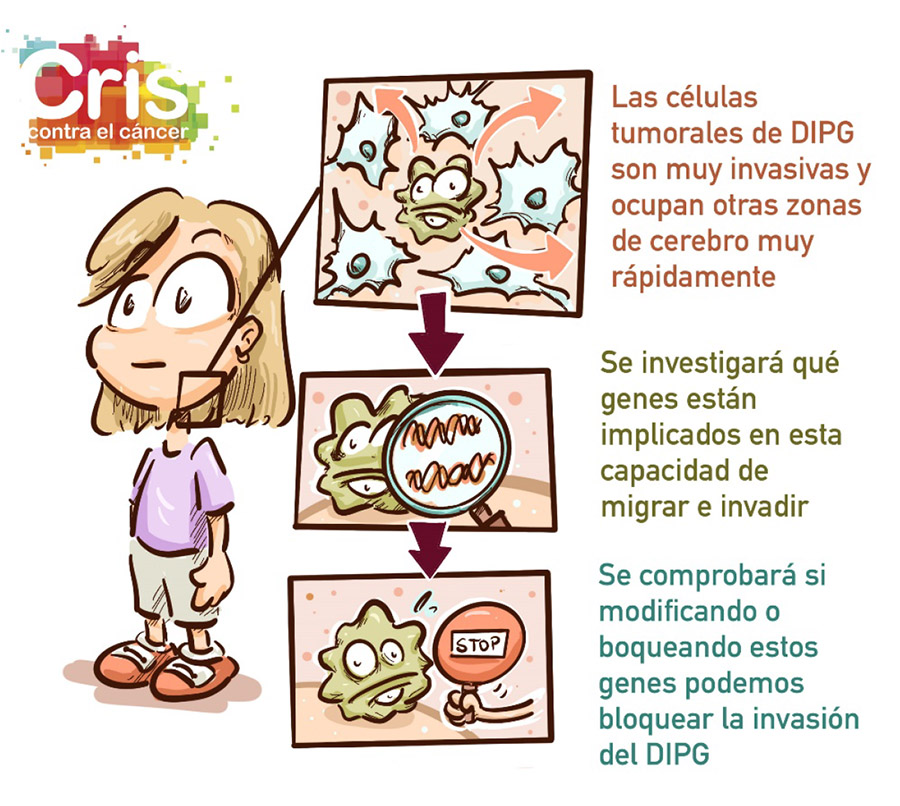
Otra de sus particularidades es que tienden a producir metástasis en otras zonas del cerebro, que dificultan el control de la enfermedad y suponen con gran frecuencia el fracaso de los tratamientos. De hecho, las células avanzan y se extienden tan rápidamente que en muchas ocasiones el tratamiento no es capaz de eliminar las células tumorales al ritmo que se expanden.
Como este tipo de cáncer se da solamente en niños y es relativamente poco común, es complicado realizar ensayos clínicos, por la dificultad de encontrar un número suficiente de pacientes. Por otro lado, los estudios moleculares muestran que este tipo de tumores son muy diferentes de los gliomas adultos, con lo que no se pueden tratar de la misma manera. De hecho, las células de DIPG infantil se extienden 10 veces más rápidamente de lo que hacen las de pacientes adultos.
Por lo tanto, es fundamental identificar genes y mutaciones que expliquen esta capacidad de migración y de invasión, para poder identificar qué puntos débiles tienen estas células y poder desarrollar tratamientos más efectivos contra las metástasis.
Proyecto:
El proyecto, iniciado a finales de 2019, consiste en identificar qué alteraciones de las células tumorales permiten predecir que niños tienen mayores probabilidades de desarrollar metástasis. Si se consigue descubrir qué genes de los tumores pueden provocar metástasis si se alteran, se podrá identificar y a los niños con mayor riesgo y tratarlos preventivamente.
La primera parte del proyecto, por tanto, se basa en identificar genes cuyas alteraciones puedan desencadenar una mayor migración e invasión. En la actualidad han encontrado 10 genes candidatos, de los cuales se seleccionarán dos para validarlos en la siguiente parte del proyecto.
Una vez identificadas las mutaciones que desencadenan las metástasis, el segundo objetivo del proyecto consiste en comprobar si los compuestos contra estas alteraciones pueden prevenir las metástasis en modelos de laboratorio.
Para ello se utilizarán, por un lado, modelos animales, en los que se introducen células de DIPG, y se intentará bloquear su capacidad de metástasis. Estos modelos proporcionan una enorme cantidad de información, pero son necesarios modelos más rápidos, manipulables y baratos. Dado que los experimentos sobre cultivos de células tumorales no emulan la complejidad del tejido cerebral, han buscado una ingeniosa alternativa para realizar los experimentos: mantener en cultivo secciones de cerebro de animales, sobre las cuales se realizan los experimentos. Estos modelos suponen una enorme ventaja, ya que incluyen muchos tipos de células, incluyendo células sanas, tumorales e incluso neuronas, mantienen la arquitectura de los tejidos, las interacciones y comunicaciones… Se trata de un tipo de experimentos muy avanzados y que muy pocos grupos son capaces de realizar.
Si finalmente estos modelos proporcionan resultados positivos, la aplicación en la práctica clínica será muy rápida, ya que los resultados se pueden traducir en nuevos tratamientos más efectivos en el frenado de las metástasis.
Últimos avances:
La primera parte del proyecto, por tanto, se basa en identificar genes cuyas alteraciones puedan desencadenar una mayor migración e invasión. En la actualidad han encontrado 10 genes candidatos, de los cuales se seleccionarán dos para validarlos en la siguiente parte del proyecto.
Una vez identificadas las mutaciones que desencadenan las metástasis, el segundo objetivo del proyecto consiste en comprobar si los compuestos contra estas alteraciones pueden prevenir las metástasis en modelos de laboratorio.
Para ello se utilizarán, por un lado, modelos animales, en los que se introducen células de DIPG, y se intentará bloquear su capacidad de metástasis. Estos modelos proporcionan una enorme cantidad de información, pero son necesarios modelos más rápidos, manipulables y baratos. Dado que los experimentos sobre cultivos de células tumorales no emulan la complejidad del tejido cerebral, han buscado una ingeniosa alternativa para realizar los experimentos: mantener en cultivo secciones de cerebro de animales, sobre las cuales se realizan los experimentos. Estos modelos suponen una enorme ventaja, ya que incluyen muchos tipos de células, incluyendo células sanas, tumorales e incluso neuronas, mantienen la arquitectura de los tejidos, las interacciones y comunicaciones… Se trata de un tipo de experimentos muy avanzados y que muy pocos grupos son capaces de realizar.
Si finalmente estos modelos proporcionan resultados positivos, la aplicación en la práctica clínica será muy rápida, ya que los resultados se pueden traducir en nuevos tratamientos más efectivos en el frenado de las metástasis.
Últimos avances:
El primer objetivo del proyecto consiste en identificar genes cuyas alteraciones puedan desencadenar una mayor migración e invasión. Para estos estudios, el equipo de Dr. Grill ha partido de células tumorales de glioma de 13 pacientes.
Al analizar las células que tenían mayor capacidad de movimiento y migración han comprobado que estas células tienen elevados niveles de un factor llamado NKX2.2. Se trata de un resultado muy interesante, puesto que podríamos estar ante un elemento clave que hace que estas células tumorales sean tan invasivas y agresivas.
Para comprobarlo, procedieron a disminuir en modelos de laboratorio los niveles de NKX2.2 y observaron que las células tumorales cambiaban su morfología y además tenían menor capacidad de invasión.
Estos resultados abren una puerta a posibles tratamientos futuros para frenar el avance de estos tumores, por lo tanto son muy relevantes.
No obstante, es difícil diseñar tratamientos directos contra factores del tipo de NKX2.2. Por ello el equipo del Dr. Grill se está centrando ahora en ver qué mecanismos celulares son los que maneja NKX2.2, y comprobar si se puede atacar alguno de estos mecanismos mediante fármacos.
Para estos estudios son fundamentales buenos modelos de laboratorio que reproduzcan con fidelidad las condiciones de un cerebro real. Tras una complicado y laborioso proceso de puesta a punto, los investigadores han logrado poner a punto el modelo de secciones de cerebro de animales, que proporcionará información vital a la hora de validar los resultados obtenidos por el laboratorio y evaluar la efectividad de potenciales terapias.